选择题(包含15小题,每小题3分,共45分,每题只有一个选项符合题意)
试题详情
唐代著名诗人白居易曾写过著名诗句:“绿蚁新醅酒,红泥小火炉”、“酥暖薤白酒,乳和地黄粥”。下列关于诗句中所提及物质的说法正确的是( )
- A、 酿酒原料高粱、谷物等主要成分为纤维素
- B、 红泥的颜色主要来自氧化铁
- C、 乳和粥的分散质是蛋白质
- D、 纯酒精比乙醇溶液杀菌效果更佳
试题详情
下列有关物质的性质和用途说法不正确的是( )
- A、 利用高纯单质硅的半导体性能,可以制成光电池
- B、 石灰石在高温下的分解产物可与SO2反应,可用于减少燃煤烟气中的SO2
- C、 Na2O2与CO2反应放出氧气,可用于制作呼吸面具
- D、 二氧化硅导电能力强,可用于制造光导纤维
试题详情
下列实验中的颜色变化与氧化还原反应无关的是( )
选项 | A | B | C | D |
实验 |
|
|
| 石蕊溶液滴入氯水中 |
现象 | 产生白色沉淀,最终变为红褐色 | 产生淡黄色沉淀 | 沉淀由白色逐渐变为黄色 | 溶液变红,随后迅速褪色 |
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
SO2是引发酸雨的主要污染物,将工业废气中的 吸收能有效减少对大气的污染、并实现资源化利用。下列离子方程式正确的是( )
吸收能有效减少对大气的污染、并实现资源化利用。下列离子方程式正确的是( )
已知常温下亚硫酸的电离平衡常数碳酸的电离平衡常数
- A、 硫酸型酸雨露置于空气中一段时间后溶液酸性增强:
- B、 用过量
溶液吸收废气中的
- C、 用过量氨水吸收废气中的
- D、 用过量
溶液吸收废气中的
试题详情
某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液,下列物质组合不符合要求的是( )

| 气体 | 液体 | 固体粉末 |
A | CO2 | 饱和Na2CO3溶液 | CaCO3 |
B | Cl2 | FeCl2溶液 | Fe |
C | HCl | Cu(NO3)2溶液 | Cu |
D | NH3 | H2O | Al(OH)3 |
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
NA为阿伏加德罗常数的值,下列说法正确的是( )
- A、 12 g 金刚石中含有的C-C键数目为4NA
- B、 标准状况下,11.2LNO与11.2LO2混合后的分子数目为0.75NA
- C、 23gNa与78gNa2O2分别与足量水反应生成的气体体积相同
- D、 100g质量分数为46%的乙醇溶液中含有氢原子数为12NA
试题详情
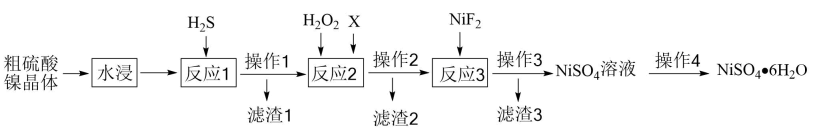
实验室进行含硫化合物性质探究的装置(夹持装置省略)如图所示,分液漏斗①中盛有浓硫酸,将其逐滴加入到试管②的固体中。下列说法正确的是( )
- A、 若②中为
固体,③中盛石蕊溶液,则③中溶液先变红后褪色
- B、 若②中为蔗糖,③中盛有溴水,能说明浓硫酸具有脱水性和氧化性
- C、 若②中为
固体,③中盛有氯化钡溶液,则③中生成白色沉淀
- D、 若②中为铜单质,③中盛有硫化氢水溶液,则③中生成黄色沉淀
试题详情
由一种金属阳离子(包括NH )与两种酸根阴离子组成的盐称为混盐,如Ca(NO3)Cl可看成CaCl2和Ca(NO3)2。向混盐Na4S2O3中加入足量稀硫酸,发生如下反应:2Na4S2O3+4H2SO4=4Na2SO4+3S↓+SO2↑+4H2O。下列说法正确的是( )
)与两种酸根阴离子组成的盐称为混盐,如Ca(NO3)Cl可看成CaCl2和Ca(NO3)2。向混盐Na4S2O3中加入足量稀硫酸,发生如下反应:2Na4S2O3+4H2SO4=4Na2SO4+3S↓+SO2↑+4H2O。下列说法正确的是( )
- A、 Na4S2O3溶液与AlCl3溶液混合可生成Al2S3沉淀
- B、 向混盐CaOCl2中加入足量稀硫酸会有Cl2产生
- C、 该反应每产生3molS,转移电子的物质的量为6mol
- D、 1molNa4S2O3固体中含离子的物质的量为5mol
试题详情
某NaAlO2、Na2CO3的混合溶液中逐滴加入 1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。(已知:H2CO3的电离平衡常数K1=4.3×10-7 , K2=5.6×10-11;Al(OH)3的酸式电离平衡常数K=6.3×10-13)则下列说法正确的是( )
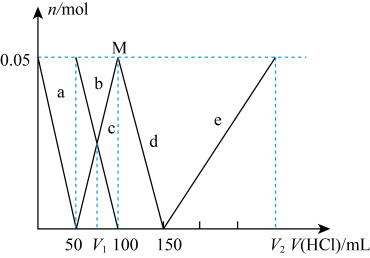
- A、 V1:V2=1:4
- B、 M点时生成的CO2为0.05mol
- C、 原混合溶液中的CO32-与AlO2-的物质的量之比为1:3
- D、 a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O
试题详情
如图所示,实验室中利用洁净的铜片(0.3 mol)和浓硫酸进行反应,实验中无气体生成,Y型管左侧得到Cu2S和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。下列说法错误的是( )
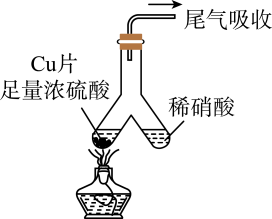
- A、 白色固体为CuSO4
- B、 NO为还原产物,b为氧化产物
- C、 NO与b的物质的量之和可能为0.2 mol
- D、 参加反应的浓硫酸中,表现氧化性的占25%
试题详情
2.48 g铁铜合金完全溶解于80 mL 4.0 mol·L-1稀硝酸中,得到标准状况下672 mL NO气体(假设此时无其他气体产生),下列说法正确的是( )
- A、 取反应后溶液,滴入几滴KSCN溶液,无血红色出现
- B、 该合金中铁与铜的物质的量之比是1∶2
- C、 反应后溶液(忽略溶液体积变化)中c(H+)=2.5 mol·L-1
- D、 向反应后的溶液中加入2.0 mol·L-1NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是120 mL
试题详情
某溶液可能含有Al3+、NH 、Fe2+、Na+、CO
、Fe2+、Na+、CO 、SO
、SO 、Cl-、NO
、Cl-、NO 中的若干种,若在该溶液中逐滴加入稀盐酸至过量,无明显现象,并得到X溶液,对
中的若干种,若在该溶液中逐滴加入稀盐酸至过量,无明显现象,并得到X溶液,对 溶液进行如图实验,下列结论正确的是(忽略水的电离,且原溶液中各离子浓度均为0.5mol/L)( )
溶液进行如图实验,下列结论正确的是(忽略水的电离,且原溶液中各离子浓度均为0.5mol/L)( )
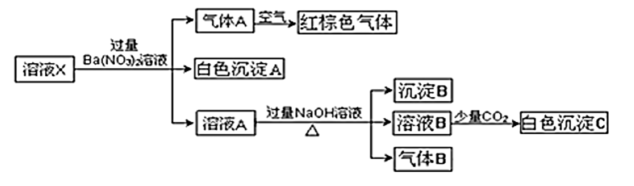

- A、 原溶液中一定存在NH
、Fe2+、SO
- B、 原溶液中可能含有NO
和Al3+
- C、 白色沉淀C可能是Al(OH)3
- D、 沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
试题详情
将由 三种固体组成的混合物溶于足量的水中,用玻璃棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加
三种固体组成的混合物溶于足量的水中,用玻璃棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加 的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示。下列有关判断不正确的是( )
的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示。下列有关判断不正确的是( )
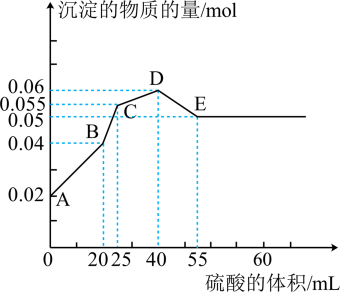
- A、 AB段发生反应的离子方程式为:
- B、 D点表示的溶液呈酸性
- C、 混合物中FeSO4和AlCl3的物质的量相等
- D、 BC段发生反应的离子方程式为: