单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
试题详情
化学与生产、生活和社会息息相关,下列有关说法错误的是( )
- A、 用于火箭发动机的碳化硅陶瓷是一种新型无机非金属材料
- B、 载人飞船采用了太阳能刚性电池阵,将太阳能转化为电能供飞船使用
- C、 合成氨的金属反应塔与外加电源的正极相连,并维持一定的电压可以防腐
- D、 运动员剧烈运动后,补充的运动饮料中含有糖类和一定浓度的NaCl、KCl等
试题详情
反应SiO2+4HF=SiF4↑+2H2O应用于玻璃雕刻。下列说法正确的是( )
- A、 SiO2属于共价化合物
- B、 HF的电子式为
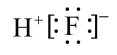
- C、 SiF4是由极性键形成的极性分子
- D、 H2O中氧原子基态价电子轨道表达式为
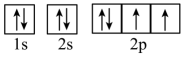
试题详情
实验室用如下图所示装置探究 与
与 溶液的反应(实验前先通入
溶液的反应(实验前先通入 排除装置中的空气)。下列说法不正确的是( )
排除装置中的空气)。下列说法不正确的是( )
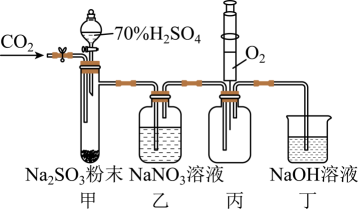
- A、 用装置甲产生
- B、 装置乙中无明显现象,则
与
未发生反应
- C、 装置丙中注入
, 产生红棕色气体,说明装置乙中
发生了氧化反应
- D、 装置丁吸收尾气并防止空气进入装置丙
试题详情
X、Y、Z、W都属于前4周期主族元素,基态X原子核外有7种运动状态不同的电子,基态Y原子的最外层电子数是其电子层数的3倍,Z是短周期金属性最强的元素,基态W原子的4p原子轨道上有5个电子。下列说法正确的是( )
- A、 第一电离能:I1(Z)<I1(X)<I1(Y)
- B、 原子半径由小到大的顺序:r(X)<r(Y)<r(Z)
- C、 W元素在周期表中位于第四周期ⅦA族
- D、 X、Y的简单气态氢化物分子的键角:X<Y
试题详情
氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以合成氨、氮的氧化物、硝酸等重要的化工原料; 能被
能被 溶液吸收生成配合物
溶液吸收生成配合物 , 减少环境污染。对于反应
, 减少环境污染。对于反应 , 下列有关说法不正确的是( )
, 下列有关说法不正确的是( )
- A、 上述反应的平衡常数表达式
- B、 适当提高
的浓度,可以加快反应速率,提高
的转化率
- C、
断裂同时有
断裂,说明达该条件下的平衡状态
- D、 其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数
试题详情
氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以合成氨、氮的氧化物、硝酸等重要的化工原料; 能被
能被 溶液吸收生成配合物
溶液吸收生成配合物 , 减少环境污染。
, 减少环境污染。 能被
能被 溶液吸收生成
溶液吸收生成 , 减少环境污染,下列说法正确的是( )
, 减少环境污染,下列说法正确的是( )
- A、
提供孤电子对用于形成配位键
- B、 该配合物中阴离子空间构型为三角锥形
- C、 配离子为
, 中心离子的配位数为6
- D、 该配合物中所含非金属元素均位于元素周期表的p区
试题详情
氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以合成氨、氮的氧化物、硝酸等重要的化工原料; 能被
能被 溶液吸收生成配合物
溶液吸收生成配合物 , 减少环境污染。下列化学反应表示正确的是( )
, 减少环境污染。下列化学反应表示正确的是( )
- A、 向硫酸铜中通入少量氨气:
- B、 向稀硝酸中加入过量铁粉:
- C、 氨气的燃烧热:
- D、 硫酸铵溶液和氢氧化钡溶液反应:
试题详情
山梨酸是常用的食品防腐剂,其结构简式如图所示,下列有关山梨酸的叙述不正确的是( )
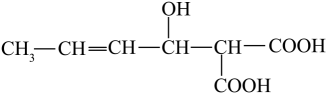
- A、 1mol该物质与足量Na反应生成1.5molH2
- B、 既能发生取代反应,又能发生加成反应
- C、 与
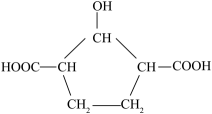 互为同分异构体
互为同分异构体 - D、 分子中所有碳原子可能在同一平面上
试题详情
利用微生物中的芽孢杆菌来处理宇航员排出的粪便,同时能得到电能。氨气与氧气分别通入燃料电池两极,最终生成常见的无毒物质,示意图如图所示。下列说法错误的是( )
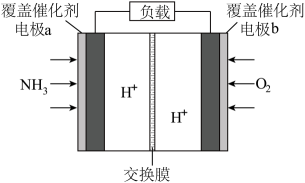
- A、 H+从a电极移向b电极
- B、 负极区发生的反应是2NH3 – 6e- = N2 +6H+
- C、 当标准状况下2.24LO2被还原,则a向b电极转移0.4mol电子
- D、 工作一段时间后电解质溶液的pH值不变
试题详情
某经预处理的含砷废水中砷元素主要以 和
和 形式存在。以其为原料制备粗
形式存在。以其为原料制备粗 的部分流程如下:
的部分流程如下:
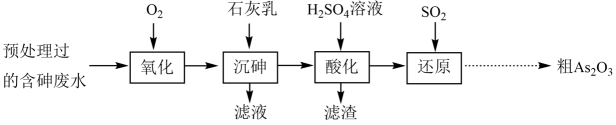
已知:①“沉砷”时发生反应:
②“酸化”时发生反应:
下列说法正确的是( )
- A、 “氧化”时每
被氧化,会消耗
- B、 “沉砷”和“酸化”可提高溶液中砷元素浓度,实现砷元素的富集
- C、 “酸化”时可用
溶液代替
溶液
- D、 “还原”过程溶液的
不断增大
试题详情
下列探究方案能达到探究目的的是( )
选项 | 探究方案 | 探究目的 |
A | 用毛皮摩擦过的带电橡胶靠近CF2Cl2液流,液流方向改变 | CF2Cl2是极性分子 |
B | 将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去 | 铁锈中含有二价铁 |
C | 将中间裹有锌皮的铁钉(如图 | 铁钉能发生吸氧腐蚀 |
D | 用pH计分别测0.1 |
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
已知:25℃,Ka1(H2C2O4)=5.0×10-2 , Ka2(H2C2O4)=5.0×10-5 , Kb(NH3·H2O)=1.8×10-5。常温下,通过下列实验探究NH4HC2O4溶液的性质,有关说法正确的是( )
实验 | 实验操作及现象 |
1 | 用pH试纸测0.1 mol·L-1 NH4HC2O4溶液的pH<7 |
2 | 向10 mL 0.1 mol·L-1 NH4HC2O4溶液中滴加10 mL 0.1 mol·L-1Ba(OH)2溶液,产生白色沉淀,过滤 |
3 | 向实验2所得白色沉淀中加入10 mL饱和Na2CO3溶液,浸泡一段时间,无明显现象,过滤,向滤渣中滴加盐酸,有气体生成 |
- A、 实验1溶液中存在:c(HC2O
)>c(NH
)>c(C2O
)>c(H2C2O4)
- B、 实验2反应的离子方程式为:HC2O
+Ba2++OH-═ BaC2O4↓+H2O
- C、 实验3中发生:BaC2O4+CO
BaCO3+C2O
,
不变时说明沉淀转化达平衡
- D、 由实验3可得:Ksp(BaC2O4)>Ksp(BaCO3)
试题详情
通过反应 可将CO2转化为C2H4.在0.1MPa,反应物起始物质的量之比n(CO2):n(H2)=1:3的条件下,不同温度下达到平衡时,CO2、H2、C2H4、H2O四种组分的物质的量分数如图所示。下列说法正确的是( )
可将CO2转化为C2H4.在0.1MPa,反应物起始物质的量之比n(CO2):n(H2)=1:3的条件下,不同温度下达到平衡时,CO2、H2、C2H4、H2O四种组分的物质的量分数如图所示。下列说法正确的是( )
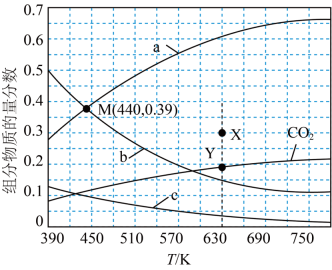
- A、 图中曲线b表示平衡时C2H4的物质的量分数随温度的变化
- B、 440℃时H2的平衡转化率为70%
- C、 保持其他条件不变,在绝热密闭容器中发生上述反应,达到平衡时,C2H4的物质的量分数比在恒温密闭容器中的小
- D、 保持其他条件不变,延长反应时间,可将平衡时CO2的物质的量分数从Y点的值升至X点的值
非选择题:共4题,共61分。
试题详情
以Al2O3为载体的钴钼废催化剂中含CoS、MoS2及少量Fe、Si、Ca等元素的物质,经系列处理可制取CoCO3、(NH4)2MoO4 , 工艺流程如图所示:
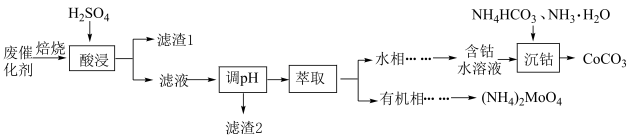
已知:①“焙烧”后各元素转化为相应氧化物,“酸浸”后钼元素转化为。
②常温下,Ksp(CoCO3)=a,Ksp(Co(OH)2)=b,Kb(NH3·H2O)=c。
试题详情
V2O5-WO3/TiO2催化剂可以催化NH3脱除烟气中的NO,反应为:4NO(g) + 4NH3(g) + O2(g)=4N2(g) + 6H2O(g)  =-1632.4kJ·mol-1 , 工业上以石煤(主要成分为V2O3 , 含有少量SiO2、P2O5等杂质)为原料制备V2O5 , 主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
=-1632.4kJ·mol-1 , 工业上以石煤(主要成分为V2O3 , 含有少量SiO2、P2O5等杂质)为原料制备V2O5 , 主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
已知:NaVO3溶于水,NH4VO3难溶于水。
回答下列问题:
试题详情
碱式氯化铜[Cu2(OH)2Cl2·3H2O]为绿色或墨绿色的结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中很稳定。
试题详情
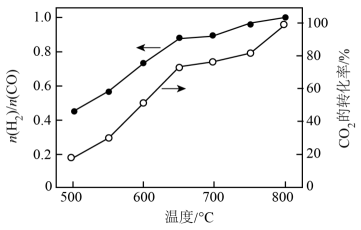
捕集并转化CO2可以有效实现碳达峰、碳中和。
Ⅰ.工业上利用两种温室气体CH4和CO2催化重整制取H2和CO,主要反应为:
反应①:
过程中还发生三个副反应:
反应②:
反应③:
反应④: △H4
将CH4与CO2(体积比为1∶1)的混合气体以一定流速通过催化剂,产物中H2与CO的物质的量之比、CO2的转化率与温度的关系如图所示:

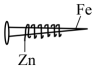 )放在滴有酚酞的NaCl溶液中,一段时间后观察铁钉周围溶液颜色变化
)放在滴有酚酞的NaCl溶液中,一段时间后观察铁钉周围溶液颜色变化
