单选题(每题2分,共42分)
试题详情
化学与生产、生活息息相关。下列说法错误的是( )
- A、 铵态氮肥和草木灰不宜混合施用
- B、 明矾溶于水可形成胶体,能用于自来水杀菌
- C、 利用
作沉淀剂,可除去废水中的
和
- D、 开发氢能、太阳能、风能、潮汐能等是实现“低碳生活”的有效途径
试题详情
现进行下列实验。
将2滴0.1 mol/L 溶液滴入2 mL 0.1 mol/L NaCl溶液中,观察到生成白色沉淀。
振荡试管,然后向其中滴加4滴0.1mol/L KI溶液,静置。观察到沉淀变为黄色。
下列关于上述实验的分析错误的是( )
- A、 步骤(1)中存在沉淀溶解平衡:
- B、 步骤(2)表明AgCl转化为AgI
- C、 步骤(2)所得上层清液中不含
- D、 该实验可以证明AgI的
比AgCl的
小
试题详情
在某温度下,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,下列说法正确的是( )
- A、 AgCl的溶解度、Ksp 均减小
- B、 AgCl的溶解度和Ksp均不变
- C、 AgCl的溶解度减小,Ksp不变
- D、 AgCl的溶解度不变,Ksp减小
试题详情
硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如下图所示。下列说法错误的是( )
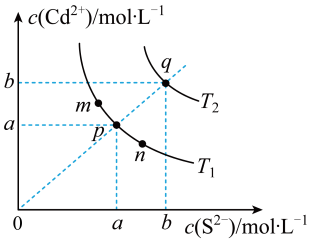
- A、 图中p和q分别为
、
温度下CdS达到沉淀溶解平衡
- B、 图中各点对应的
的关系为:
- C、 向m点的溶液中加入少量
固体,溶液中
浓度降低
- D、 温度降低时,q点饱和溶液的组成由q沿qp线向p方向移动
试题详情
常见的铅蓄电池的电极材料为PbO2和Pb,电解液为30%的稀硫酸溶液,电池放电的总反应为PbO2+Pb+2H2SO4 2PbSO4+2H2O,则下列说法正确的是( )
2PbSO4+2H2O,则下列说法正确的是( )
- A、 PbO2为电池的负极
- B、 充电时电子由正极流向负极
- C、 充电时阴极发生氧化反应
- D、 放电时电解液的pH值逐渐增大
试题详情
某科研机构研发的NO—空气燃料电池的工作原理如图所示,下列叙述正确的是
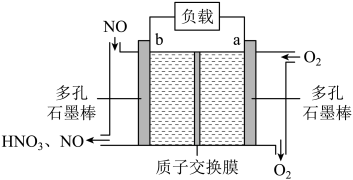
- A、 a电极为电池负极
- B、 电池工作时
透过质子交换膜从右向左移动
- C、 b电极的电极反应:
- D、 当外电路中通过
电子时,a电极处消耗
试题详情
银锌电池用作各种电子仪器的电源,电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O=2Ag+Zn(OH)2 , 下列说法不正确的是( )
- A、 原电池放电时,负极上发生反应的物质是Zn
- B、 正极发生的反应是Ag2O+2e−+H2O=2Ag+2OH-
- C、 工作时,负极区溶液c(OH-)减小
- D、 溶液中OH-向正极移动,K+、H+向负极移动
试题详情
将AgCl分别投入下列溶液中:
1. 40mL0.03mol·L-1的HCl溶液
2. 50mL0.03mol·L-1的AgNO3溶液
3. 30mL0.02mol·L-1的CaCl2溶液
4. 10mL蒸馏水
AgCl的溶解度由大到小的顺序是____。
- A、 1=2>3>4
- B、 3>1=2>4
- C、 4>1=2>3
- D、 4>3>2>1
试题详情
25℃时,CuS和ZnS悬浊液中对应离子浓度的对数值 与
与 的关系如图所示。下列说法不正确的是( )
的关系如图所示。下列说法不正确的是( )
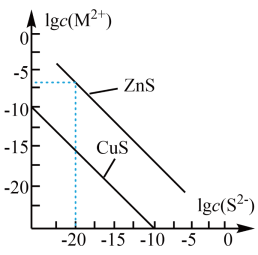
- A、 25℃时,ZnS的溶解度更大
- B、 25℃时,
约为
- C、 在ZnS悬浊液中加入
, 可以发生反应
- D、 已知温度升高,CuS的溶解度增大,则图中对应线段向下平移
试题详情
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图。下列说法正确的是( )
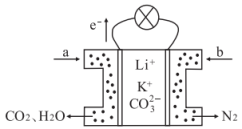
- A、 此电池在常温时也能工作
- B、 正极电极反应式为:O2+2CO2+4e-=2
- C、
向正极移动
- D、 a为CH4 , b为CO
试题详情
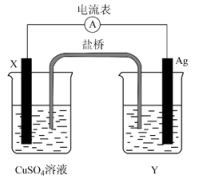
据文献报道,一种新型的微生物脱盐电池的装置如图所示,关于该电池装置说法正确的是( )

- A、 该装置可以在高温下工作
- B、 X、Y依次为阳离子、阴离子选择性交换膜
- C、 该装置工作时,电能转化为化学能
- D、 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
试题详情
有关下列装置的说法不正确的是( )

- A、 图1所示不能构成原电池
- B、 图2锌锰干电池属于一次电池,锌作负极
- C、 图3是“纸电池”,Zn片失去电子,发生氧化反应
- D、 图4电池Al电极反应式为:Al-3e-+3H2O=Al(OH)3+3H+
试题详情
已知:20℃时,Ksp(AgCl)=1.1×10﹣10 , Ksp(AgBr)=2.0×10﹣13。将AgCl和AgBr的饱和溶液等体积混合,再逐滴加入足量浓AgNO3溶液,充分反应后,下列说法正确的是( )
- A、 只有AgBr沉淀生成
- B、 AgCl与AgBr沉淀等量生成
- C、 AgCl与AgBr沉淀都有,但是以AgCl为主
- D、 AgCl与AgBr沉淀都有,但是以AgBr为主
试题详情
工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH接近4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:
试题详情
要除去CuCl2溶液中的Fe3+ , 甲同学不知道调整溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38 ,
Cu(OH)2的溶度积Ksp=3×10-20 , 通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1 ,